冷冻电子显微镜揭示转运蛋白如何非常有效地起作用
格罗宁根大学的科学家对细菌用于输入天冬氨酸的运输复合物的结构进行了独特的绘制。使用冷冻电子显微镜对蛋白质成像。结果表明运输机工作效率很高。这特别有趣,因为类似的转运蛋白对于人脑细胞之间的信号转导至关重要。研究结果于2月21日发表在《自然通讯》上。
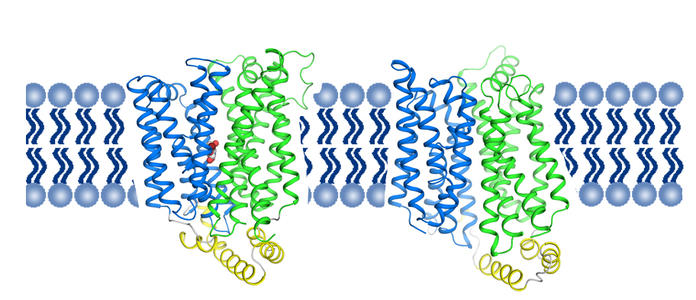
细胞利用无数的运输蛋白将物质穿梭在它们的膜上:食物和构件被进口,毒素和其他废物被出口。一个例子是天冬氨酸转运蛋白,细菌用来输入该氨基酸。格罗宁根生物分子科学与生物技术学院的Dirk Slotboom教授领导的膜酶研究小组和Albert Guskov博士领导的结构生物学小组对这种转运蛋白进行了数年的研究,部分原因是因为它是去除人类转运蛋白的良好模型来自突触间隙的神经递质谷氨酸,这是我们脑细胞工作的重要步骤。
货梯
细菌膜中的天冬氨酸转运蛋白是三聚体,这意味着三个相同的单元紧密地结合在一起形成一个复合物。从环境中提取天冬氨酸,通过细胞膜运输并在细胞内部释放。每单位三个钠离子为这一转变提供动力,这可以与货物提举相提并论:天冬氨酸和钠离子与部分转运蛋白结合,然后进入细胞。交付天冬氨酸后,它再次退出。
Slotboom解释说:“我们以前使用X射线晶体学绘制了具有天冬氨酸的配合物的结构图。”这些研究表明,大楼中的三个电梯始终处于同一位置。“但是,生化证据表明它们可能彼此独立地起作用。”这就是为什么他决定在膜内部更自然的环境中研究运输复合体的原因。这是使用冷冻电子显微镜完成的,这是一种创建蛋白质复合物图像的方法。
问题
将蛋白质插入脂质双层的小块中,并通过一条蛋白带将它们保持在一起。这些脂质纳米盘被快速冷冻并在低温电子显微镜下研究。通过组合大量图像,以3.2-3.5埃的分辨率对运输复合物成像。
我们所看到的与通过X射线晶体学获得的结构有很大的不同:在大多数复合体中,升力处于不同的位置,与独立运动一致。”
泄漏
这就提出了为什么蛋白质会形成三聚体复合物的问题。Arkhipova:“每个单元的提升部分都需要支撑才能穿过膜。锚定在膜片内部的单个升降机可能开始摆动。但是三台带有相连锚的电梯形成了稳定的结构。”
另一种可能性是,三聚体的锚固部分使围绕它的膜片更薄,更不牢固,这使举升机更容易通过。Slotboom解释说:“单体只会在一侧产生这种作用,因此在能量上不利。”确实,对包含转运复合物的脂质纳米圆盘的研究显示了双层的弯曲。
这些结构还提供了运输系统如何防止钠泄漏的指示。Slotboom:“升降机有一种门,当它打开时会伸出并阻止升降机移动。”运输过程首先需要两个钠离子进入提升机。带负电荷的天冬氨酸然后可以在内部结合,这使第三钠离子进入并结合到门上,从而将门关闭。因此,升降机无法仅运输钠,钠会消散跨驱动运输的膜的钠梯度。
大脑
Slotboom说:“这使系统非常高效”。对于细菌而言,这种效率可能只是很小的选择性进化优势。但是,对于我们大脑中类似的谷氨酸转运蛋白,它至关重要。谷氨酸被神经细胞排泄到突触间隙中,并激发邻近的神经元。激励后,必须非常快速有效地将其去除,以减少信号传输中的噪声。Slotboom:“对于这个系统,至关重要的是没有泄漏。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
预约试驾比亚迪元PLUS前,需注意以下几点:首先确认车型配置与预算是否匹配,了解车辆性能及续航信息。其次,...浏览全文>>
-
小鹏G7试驾前,新手需掌握以下步骤:1 预约试驾:通过官网或APP预约,选择合适时间和地点。2 准备证件:...浏览全文>>
-
预约别克GL8试驾,4S店提供专业且贴心的服务流程。首先,可通过电话或线上平台提前预约,选择合适的时间与车型...浏览全文>>
-
试驾奇瑞新能源QQ多米,新手可参考以下流程:1 预约试驾:通过官网或4S店预约,选择合适时间。2 到店接...浏览全文>>
-
试驾宝马X1,感受紧凑型SUV中的驾驶乐趣。轻踩油门,2 0T发动机迅速响应,动力输出平顺有力,提速迅猛。方向...浏览全文>>
-
福特烈马预约试驾,线上+线下操作指南:线上预约:访问福特官网或官方App,选择“试驾预约”,填写个人信息、...浏览全文>>
-
奥德赛试驾预约,简单几步,开启完美试驾之旅。只需三步,即可轻松完成预约:第一步,访问官网或拨打热线;第...浏览全文>>
-
想要快速锁定雷克萨斯ES的试驾名额,可采取以下方法:首先,访问雷克萨斯官网或使用官方APP,填写基本信息并提...浏览全文>>
-
想体验理想L8的智能与豪华?现在即可在线下预约试驾!作为一款中大型SUV,理想L8融合了家庭出行与科技感,搭载...浏览全文>>
-
试驾SRM鑫源摩托车时,需注意以下几点:首先,确认车辆状态,检查刹车、轮胎、灯光等是否正常。其次,选择安全...浏览全文>>
- 理想L8试驾线下预约
- 宝马X1预约试驾,4S店体验全攻略
- 华晨新日预约试驾,如何享受4S店的专业服务?
- 小鹏P7+试驾,开启完美驾驭之旅
- 元UP试驾预约,快速上手指南
- 金龙汽车预约试驾,新手试驾注意事项
- 蓝电试驾预约,如何快速预约并体验驾驶乐趣?
- 乐道L60试驾,如何在4S店快速预约?
- 小鹏MONA M03试驾,开启完美驾驭之旅
- 试驾别克昂科威,轻松几步,畅享豪华驾乘
- 云度新能源预约试驾有哪些途径
- 乐道L60试驾,如何在4S店快速预约?
- 哈弗大狗试驾,开启完美驾驭之旅
- 试驾深蓝汽车深蓝S05,线上+线下操作指南
- 日产奇骏试驾怎么预约
- 鸿蒙智行问界M9预约试驾,新手试驾注意事项
- 奇瑞艾瑞泽8预约试驾怎么预约
- 荣威预约试驾全攻略
- 坦克试驾,开启完美驾驭之旅
- 吉利银河预约试驾需要注意什么
